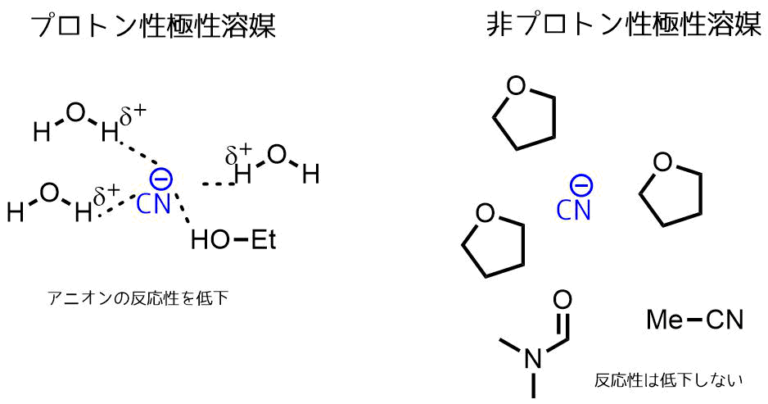
プロトン性溶媒 (プロトンせいようばい、英語: protic solvent)は、酸素(ヒドロキシ基)や窒素(アミン)等に結合した水素原子を含む溶媒である。一般に、不安定性を持つヒドロン(H )を含む溶媒はプロトン性溶媒と呼ばれる。そのような溶媒の分子は、プロトン(H )を容易に供与する。
逆に、非プロトン性溶媒 (ひプロトンせいようばい、英語: aprotic solvent)はプロトンを供与することができない。
プロトン性極性溶媒
プロトン性極性溶媒は、しばしば塩を溶解するために使用される。一般に、これらの溶媒は高い誘電率及び高い極性を有する。
プロトン性溶媒の共通する性質
- 溶媒は水素結合を示す
- 溶媒は酸性水素を持つ(エタノールのような非常に弱い酸であるかもしれない)
- 溶媒は塩を溶解する
- 孤立電子対によるカチオン
- 水素結合によるアニオン
例としては、水、大部分のアルコール、ギ酸、フッ化水素及びアンモニアが挙げられる。プロトン性極性溶媒はSN1反応には好都合であるが、非プロトン性極性溶媒はSN2反応に好都合である。
非プロトン性極性溶媒
非プロトン性極性溶媒は、酸性水素を欠く溶媒である。従ってそれらは水素結合供与体ではない。これらの溶媒は、一般に中間的な誘電率および極性を持つ。「極性非プロトン性」という用語の使用は推奨されないが、IUPACは、高い誘電率及び高い双極子モーメントの両方を有するような溶媒を記載しており、その例はアセトニトリルである。 IUPACの基準を満たす他の溶媒には、N,N-ジメチルホルムアミド、ヘキサメチルリン酸トリアミド、ジメチルスルホキシド等がある。
非プロトン性溶媒の共通する性質
- 溶媒は水素結合を受け入れられる
- 溶媒は酸性水素を持たない
- 溶媒は塩を溶解する
基準は相対的かつ非常に定性的である。非プロトン性溶媒については、ある範囲の酸性度が認められる。塩を溶解する能力は、塩の性質に強く依存する。
一般的な非プロトン性極性溶媒は、グリニャール試薬やn-ブチルリチウムのような強塩基には使用できない。これらの試薬は、ニトリル、アミド、スルホキシド等ではなく、エーテルを要する。テトラヒドロフランはエーテルであると同時に非プロトン性極性溶媒としての性質を持ち、グリニャール試薬の溶媒としてジエチルエーテルと並んでよく使われる。
主な溶媒の性質
溶媒は、非極性、極性非プロトン性及びプロトン性極性溶媒に定性的に分類され、しばしば誘電率によって並べられる。
関連項目
- 自動プロトン分解
出典
- Loudon, G. Mark. Organic Chemistry 4th ed. New York: Oxford University Press. 2002. pg 317.